ACTIVIDADES
1. En la tabla periódica, el arsénico (ᵌᵌAs) tiene como vecinos más próximos los elementos cuyos números atómicos son:15, 32, 34 y 51. Responde ¿Cuáles de estos elementos presentan propiedades similares a las del arsénico?
El arsénico tiene propiedades en común con el Germanio(32) y el Antimonio(51) ya que forman parte de los elementos denominados metaloides o semimetales, además que elementos tienen propiedades intermedias entre metales y no metales y son semiconductores
2.- Teniendo en cuenta los siguientes iones: Nˉᵌ, Oˉ², Fˉ¹, Naᶧ¹ y Mgᶧ²
a) ¿Qué característica tienen en común?
Lo que tienen en común es que son isoelectrónicos o sea que tienen la misma cantidad de electrones, que todos son iones, que todos pertenecen al Grupo A.
N 3- : 7+ 3 = 10 electrones
O 2- : 8 + 2 = 10 electrones
F 1- : 9 + 1 = 10 electrones
Na 1+: 11 - 1 = 10 electrones
Mg 2+: 12 - 2 = 10 electrones
b) Modelo que permita representar adecuadamente la ubicación de sus electrones en los respectivos niveles de valencia.
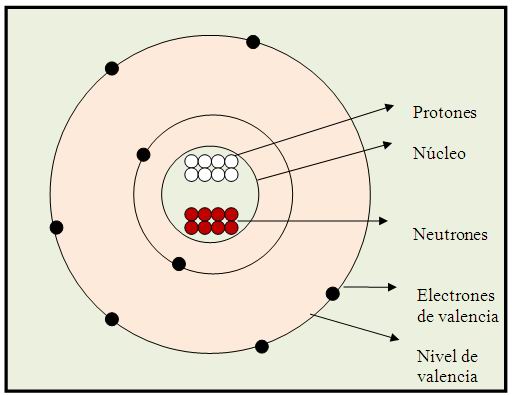
c) Ordena de manera ascendente los iones de acuerdo con su tamaño.
Mg+2 < Na+1 < F-1 < O-2 < N-3
La explicación es que siempre son mayores los aniones que los cationes y son más grandes cuanto mayor es su carga. En el caso de los cationes, cuanto mayor es su carga menor es su tamaño.

3. Utiliza la información sobre las propiedades periódicas de los elementos para responder a las siguientes preguntas.
a) ¿Por qué el radio atómico del sodio es menor que el del rubidio?
Porque al tener un bajo numero de electrones estos se encuentran en niveles cerca del nucleo, el cual produce una atracción a los electrones achicando el radio, a diferencia del rubidio que tiene mas electrones los cuales llegan a ocupar niveles mas lejanos al núcleo, por ende se genera menos atracción y el radio es mas amplio.
b) ¿Por qué el selenio presenta mayor energía de ionización que el calcio?
Esto se debe a que la energía de ionización en un grupo de la tabla periódica (IA, IIA, IIIA,etc..) aumenta desde abajo hacia arriba y en un período (Líneas horizontales de la tabla periódica) aumenta de izquierda a derecha. Puedes revisarlo aquí
c) ¿Cuál de los siguientes elementos presenta menor energía de ionización: Bi, Ba, Re y Cs?
El Bismuto, Bi porque esta mas cercano al gas noble Radón Rn que tiene la configuración mas estable y por lo tanto de mayor energía de ionización.
d) ¿Cuál de los elementos del grupo IVA presenta menor afinidad electrónica?
El Rf (Rutherforio ), pues la afinidad electrónica aumenta en los grupos de abajo hacia arriba y es mayor cuando decrece el número atómico.
e) ¿Cuál de los elementos del grupo IIA es el más pequeño?
El más pequeño es el berilio (Be)
4. La construcción de la tabla periódica que conocemos en la actualidad es fruto de múltiples propuestas consolidadas a través de la historia. Mediante un esquema, explica algunas de estas propuestas justificando sus ventajas y desventajas en la organización periódica de los elementos químicos.

5. El aluminio es uno de los metales más utilizados en la industria para fabricar electrodomésticos
a) Indica qué propiedades presenta este elemento para ser empleado en la construcción de aparatos.
*Se puede fundir
*Se puede moldear
*Es muy dúctil
*No se oxida fácilmente
*Es liviano
*Absorbe el calor con el fin de soportar y resistir la temperatura de la electricidad
b) Explica cuál la configuración electrónica de este elemento.
Al: 1s2 , 2s2 , 2p6 , 3s2, 3p1
(2 +2 +6 +2 +1 = 13)
Cuando el aluminio forma compuestos, solo puede tener valencia +3, esto quiere decir que queda con carga +3, o sea, pierde 3 electrones, por lo que le quedan 10. Así que ahora escribimos la configuración electrónica hasta sumar 13 electrones
Al⁺³: 1s2 , 2s2 , 2p6
(2 +2 +6 = 10)
c) ¿ En qué bloque s, p, d o f de la tabla periódica está ubicado?
El aluminio es un elemento químico que pertenece al grupo de los metales del bloque p porque en su configuración electrónica termina en 3p por tanto el aluminio está en el bloque p. El aluminio tiene sus electrones de valencia en el orbital p.
6. Los elementos conocidos como actínidos y lantánidos se encuentran ubicados en la parte inferior de la tabla periódica, bloque F.
a) ¿Qué característica generales presentan estos elementos?
Lantánidos: Los lantánidos son un grupo de elementos que forman parte del periodo 6 de la tabla periódica. Estos elementos son llamados tierras raras debido a que se encuentran en forma de óxidos, y también, junto con los actínidos, elementos de transición interna.
b) ¿ Qué similitud existe en sus configuraciones electrónicas?
Sus electrones van llenando orbitales f.
c) ¿A qué períodos pertenecen estos elementos?
Lantánidos, Periodo 6, Su configuración termina desde 4f1 ---------> 4f14
Actínidos, Periodo 7, Su configuración termina desde 5f1 ---------> 5f14
Actínidos, Periodo 7, Su configuración termina desde 5f1 ---------> 5f14
7) En el hipotético caso de un científico hubiera encontrado el elemento con Z = 120, analiza y responde las siguientes preguntas.
a) ¿ En qué lugar de la tabla periódica se ubicaría?
Lo ubicaría en el grupo 2 y periodo 8, siguiendo el orden de número atómico creciente en la tabla periódica (quedaría abajo del Radio).
b) ¿Qué propiedades presentaría?
Al pertenecer al grupo de los metales alcalinotérreos sería muy reactivo, según las propiedades periódicas conocidas. Posiblemente tendría una electronegatividad baja, una valencia de +2 y reaccionaría violentamente con aire y agua para formar óxido e hidróxido (base fuerte) respectivamente.
c)¿Qué nombre provisional se le asignaría?
Se le asignaría el nombre Unbinilio; "un-" del latín unus=uno, "-bi" del latín bis=dos, "-nihil" del latín nihil=nada(cero).
8. Justifica la afirmación "tanto en el Universo, en el planeta Tierra, como en los seres vivos se encuentran los mismos elementos químicos".
La razón biológica porque tanto en el Universo, en el planeta Tierra, como en los seres vivos deben compartir un único y ultimo pasado común universal. Si bien se ha propuesto que el inicio de la vida pueden haber sido moléculas autorreplicantes como el ARN, o ensamblajes de nanocélulas. Sin embargo, los científicos están de acuerdo en que todos los organismos existentes comparten ciertas características ―incluyendo la presencia de estructura celular y de código genético― que estarían relacionadas con el origen de la vida. Ejemplo: El hidrógeno es el elemento más abundante del Universo conocido porque se encuentra tanto en los seres vivos como los seres humanos, las plantas; en el planeta Tierra: los ríos, océanos. etc. También están elementos químicos como el helio, el oxígeno, el carbono, el neón.
9. Responde a las preguntas con base en las siguientes ecuaciones
Ca + energía= Caᶧ² + 2ᵉ̄
F+ electrón = F ̄ ¹
a) ¿Qué propiedad periódica representa la primera ecuación?
Representa el potencial de ionización que es la energía necesaria para quitar un electrón.
b) ¿Por qué el calcio puede perder únicamente dos electrones?
Porque el calcio posee solo dos electrones en la capa externa y por lo tanto es lo único que puede perder.
c) ¿Qué clase de ion forma este átomo al perder dos electrones y le flúor al ganar un electrón ?
Que el calcio forma el catión Ca 2+ y el flúor forma el anión F 1-
d) ¿ Qué propiedad periódica representa la segunda ecuación?
Representa la propiedad de la electronegatividad.




